تنظیم چرخه سلولی از طریق پست های بازرسی

برای ایجاد یک ارگانیسم کامل از یک سلول، سلول باید تقسیم شود. در حین تقسیم سلولی، سلول محتویات آن را کپی می کند و آن را به دو قسمت تقسیم می کند. هدف اصلی از تقسیم سلولی، تکثیر دقیق DNA ارگانیسم و محتوای یکنواخت آن است. چرخه سلولی در چهار مرحله با تنظیم انرژی در هر مرحله پیش می رود. تقسیم سلولی در مراحل مختلف توسط مکانیسم های مختلف در نقاط بازرسی چرخه سلولی تنظیم می شود.
در یوکاریوت ها، چرخه سلولی شامل چهار مرحله است:
- G1: سلول ها به طور فعال در حال رشد هستند و برای همانندسازی DNA آماده می شوند.
- فاز S: همانندسازی DNA.
- G2: سلول ها هنوز در حال رشد هستند و پروتئین های مورد نیاز برای تقسیم را سنتز می کنند.
- فاز M (میتوز).: کروموزوم های تکراری (کروماتیدهای خواهر) و محتویات سلولی به دو سلول دختر تقسیم می شوند که هر کدام یک کپی کامل از DNA دارند.
فرآیند تقسیم سلولی نمی تواند تصادفی باشد و باید به شدت کنترل شود، زیرا تقسیم کنترل نشده می تواند منجر به بیماری هایی مانند سرطان شود. نظارت و حفظ یکپارچگی ژنومی در طول چرخه سلولی از طریق شبکه پیچیده ای از مسیرهای ترمیم DNA و نقاط بازرسی چرخه سلولی انجام می شود. نقاط بازرسی چرخه سلولی در سیستم نقش دارند زیرا آسیب DNA را تشخیص می دهند و در حالت استراحت باعث توقف چرخه سلولی می شوند تا زمانی که آسیب ترمیم شود. مکانیسم عمل نقاط بازرسی چرخه سلولی با تنظیم فعالیت سیکلین ها و CDK ها است.
Cyclins و CDKs
سیکلین زیرواحد تنظیم کننده است زیرا غلظت آن با پیشرفت سلول ها در چرخه سلولی تغییر می کند. زیرواحد کاتالیزوری CDK نامیده می شود و گروه های فسفات را از ATP به باقی مانده اسید آمینه خاصی در بسترها با فسفریله کردن آنها منتقل می کند. CDKها فقط زمانی که به سیکلین متصل می شوند فعالیت کیناز را نشان می دهند. فسفوریلاسیون پروتئینهای دخیل در کنترل چرخه سلولی توسط کمپلکسهای سیکلین-CDK در مکانهای تنظیمی آنها را فعال یا مهار میکند.

نقاط بازرسی زیادی وجود دارد که چرخه سلولی را تنظیم می کند. اما سه مورد اصلی هستند
1. ز1/S (محدود کننده) ایست بازرسی
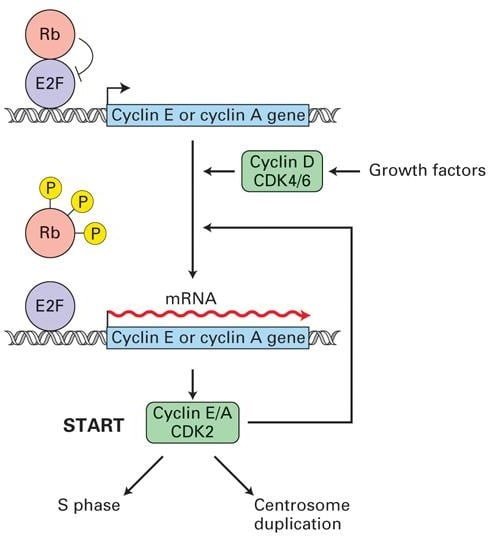
آسیب DNA، در دسترس بودن مواد مغذی و فاکتورهای رشد در G1 ایست بازرسی اگر شرایط نامناسب باشد، سلول دیگر اجازه ورود به فاز S را نخواهد داشت. تحریک G0 سلول های دارای فاکتورهای رشد و میتوژن بیان سیکلین D، CDK4/6 و فاکتور رونویسی E2F را القا می کنند.
نقش p53 در تنظیم آسیب DNA
اگر آسیب DNA قابل توجهی وجود داشته باشد، p53 توسط کینازها فسفریله می شود (ATM/ATR و Chk2/Chk1 کینازها نقش اصلی را ایفا می کنند)، که از اتصال آن به Mdm2 جلوگیری می کند. Mdm2 یک لیگاز یوبیکوئیتین است که با هدف قرار دادن p53 برای تخریب آن را مهار می کند.1. سپس p53 تولید p21 را تحریک می کند، پروتئینی که به کمپلکس های سیکلین-CDK متصل می شود و آن را مهار می کند و منجر به توقف چرخه سلولی می شود تا زمانی که آسیب DNA ترمیم شود و سطح p21 کاهش یابد. 2. اگر آسیب DNA برگشت ناپذیر باشد، p53 باعث آپوپتوز (مرگ برنامه ریزی شده سلولی) می شود و از تکرار کروموزوم های آسیب دیده جلوگیری می کند.
نقش پروتئین Rb
پروتئین Rb (سرکوبگر تومور) به بیان E2F متصل شده و آن را مهار می کند3. هنگامی که بیان G1 cyclin-CDKs روشن می شود، cyclinD-CDK4/6 تولید شده پروتئین Rb را فسفریله می کند، آن را غیرفعال می کند و فاکتور رونویسی E2F را آزاد می کند. سپس E2F بیان ژنهای رونویسی مورد نیاز برای ورود به فاز S را تحریک میکند، بهویژه ژنهای کدکننده آنزیمهای سنتز DNA و سیکلین-CDKs فاز S.
کمپلکس cyclinE/A-CDK2 فاز S در ابتدا مهار شد، در حالی که G1/S فاز سیکلین-CDKs مهارکننده ها را فسفریله می کنند. پس از انتشار، cyclinE/A-CDK2 پروتئینهای تنظیمکننده مرتبط با منشاء همانندسازی کروموزومی را فسفریله میکند و باعث شروع سنتز DNA میشود.
2. ز2 ایست بازرسی
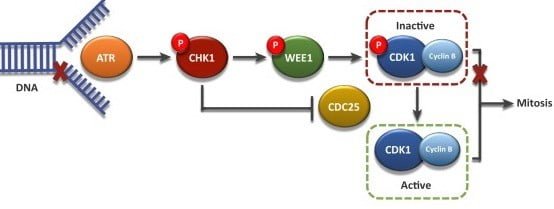
D2 ایست بازرسی تضمین می کند که کروموزوم ها همانندسازی می شوند و DNA تکثیر شده سلول قبل از ورود به میتوز آسیب نمی بیند. سیکلین B میتوتیک به تدریج تجمع می یابد و به CDK1 متصل می شود. هنگامی که سیکلین B به CDK1 متصل می شود، کمپلکس حاصل به عنوان MPF شناخته می شود4. این مجموعه به عنوان یک سیگنال برای G عمل می کند2 سلول وارد میتوز می شود و القا می کند:
- تراکم کروموزوم ها،
- انهدام پاکت هسته ای،
- مونتاژ دوک میتوزی و
- ترتیب کروموزوم های متراکم در ناحیه استوایی.
قبل از ورود به میتوز، CDK1 در حالت غیر فعال (فسفریله) توسط کیناز Wee1 حفظ می شود. در طول G2انتقال /M، Wee1 توسط PLK1 فسفریله می شود 5. سپس Wee1 فسفریله شده توسط مسیر لیگاز یوبیکوئیتین SCF تجزیه می شود. PLK1 بیشتر Cdc25 را از طریق فسفوریلاسیون فعال می کند. تیروزین فسفاتاز cdc25 مسئول دفسفوریلاسیون و فعال سازی CDK1 است. 6. اثر ترکیبی تخریب Wee1 و فعال سازی Cdc25 منجر به حذف خالص یک گروه فسفات بازدارنده می شود و کمپلکس cyclinB-CDK1 را فعال می کند.
3. نقطه کنترل M (نقطه کنترل اسپیندل)
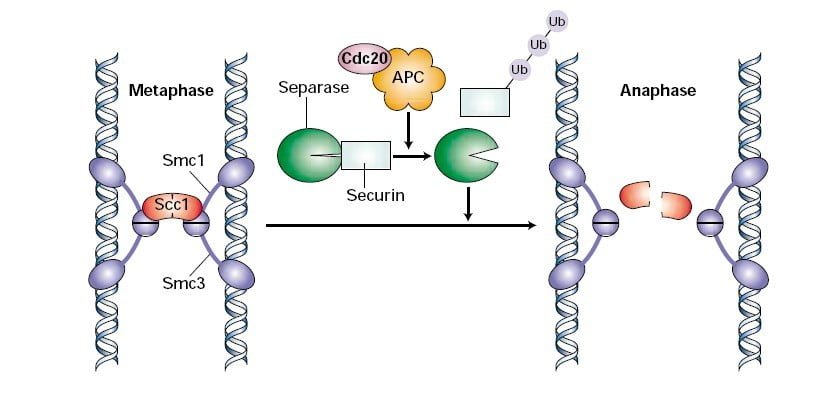
نقطه بازرسی M همچنین به عنوان نقطه بازرسی اسپیندل شناخته می شود زیرا نقش اصلی آن اطمینان از اتصال صحیح تمام کروماتیدهای خواهر به میکروتوبول های دوک است. کروماتیدهای خواهری که از تکثیر DNA در فاز S تشکیل میشوند، توسط پروتئینهای حلقهای شکل به نام کمپلکس کوهزین در سانترومرها در کنار هم نگه داشته میشوند. Cdc20 APC/C یوبیکوئیتین لیگاز را فعال می کند که مسئول پلی یوبی کوئیتیناسیون سکورین است. سکورین یک مهارکننده آنزیمی به نام سپاراز است. بعد از اینکه پروتئازوم ها سکورین را تجزیه می کنند، جداسازی جزء Scc1 کمپلکس کوهزین را می شکافد و کروماتیدهای خواهر را جدا می کند.7.
اگر کشش ناهمواری وجود داشته باشد و میکروتوبول ها به درستی به کروموزوم ها متصل نباشند، این یک سیگنال خطا در داخل سلول ایجاد می کند. Mad2 سیگنال خطا را تشخیص می دهد و فعالیت Cdc20 را مهار می کند. تخریب سکورین و انتقال از متافاز به آنافاز سلول را به تاخیر می اندازد. اتصال صحیح اسپیندل Mad2 را غیرفعال میکند و Cdc20 را آزاد میکند تا باعث تخریب سکورین شود.
بعداً در طول آنافاز، APC/C سیکلینهای میتوزی را پلیآبیکوئیتین میکند که منجر به تخریب آنها میشود.3. کاهش غلظت میتوزی سیکلین-CDK کیناز منجر به دفسفوریلاسیون پروتئین های متراکم کروموزوم می شود. کروموزوم ها متراکم می شوند و غشاهای هسته ای دوباره سنتز می شوند. سپس سلولها وارد تلوفاز میشوند، جایی که سیتوکینز انجام میشود و چرخه سلولی کامل میشود.
بیشتر بدانید
منابع
- بارتک جی، لوکاس جی (2001). پست های بازرسی فاز G1 و S پستانداران در پاسخ به آسیب DNA. Curr Opin Cell Biol، 13(6)، 738-747. doi:10.1016/S0955-0674(00)00280-5
- Vermeulen K، Van Bockstaele DR، Berneman ZN. (2003). چرخه سلولی: مروری بر تنظیم، مقررات زدایی و اهداف درمانی در سرطان سلول پرولایف، 36 (3)، 131-149. doi:10.1046/j.1365-2184.2003.00266.x
- Cross FR، Buchler NE، Skotheim JM. (2011). تکامل شبکه ها و توالی ها در کنترل چرخه سلولی یوکاریوتی Philos Trans R Soc Lond B Biol Sci, 366(1584), 3532-3544. doi:10.1098/rstb.2011.0078
- مورگان DO. (1997). کینازهای وابسته به سیکلین: موتورها، ساعتها و ریزپردازندهها. Annu Rev Cell Dev Biol، 13، 261-291. doi:10.1146/annurev.cellbio.13.1.261
- مارتین وای، دومینگوئز-کلی آر، فریره آر. (2011). بینش جدید در مورد حفظ یکپارچگی ژنومی: Wee1 Mus81/Eme1 را تنظیم می کند. Cell Div, 6, 2-5. doi: 10.1186/1747-1028-6-21
- Hoffmann I, Clarke PR, Marcote MJ, Karsenti E, Draetta G. (1993). فسفوریلاسیون و فعال سازی cdc25-C انسانی توسط cdc2-cyclin B و دخالت آن در خودتقویت MPF در میتوز. EMBO J، 12 (1)، 53-63. https://pubmed.ncbi.nlm.nih.gov/8428594.
- Ciosk R، Zachariae W، Michaelis C، Shevchenko A، Mann M، Nasmyth K. (1998). یک کمپلکس ESP1/PDS1 از دست دادن انسجام کروماتید خواهر را در انتقال متافاز به آنافاز در مخمر تنظیم میکند. سلول، 93 (6)، 1067-1076. doi:10.1016/S0092-8674(00)81211-8
اختصارات
APC/C: کمپلکس/سیکلوزوم محرک آنافاز
ATM: آتاکسی تلانژکتازی جهش یافته کیناز
ATP: آدنوزین تری فسفات
ATR: کیناز مرتبط با آتاکسی تلانژکتازی
Cdc20: پروتئین چرخه تقسیم سلولی 20
Cdc25: پروتئین چرخه تقسیم سلولی 25
CDKs: کینازهای وابسته به سیکلین
Chk: ایست بازرسی کیناز
DNA: اسید دئوکسی ریبونوکلئیک
Mad2: Mitotic Arrest Deficient 2
Mdm2: Mouse Double Minute 2
MPF: عامل محرک بلوغ
PLK1: کیناز 1 شبیه پولو
Rb: رتینوبلاستوما
SCF: پروتئین Skp 1-Cul 1-Fbox



